0
Porównywać
0
Porównywać
 0
Kosz
0
Kosz

Chromatografia
Dopuszczalne dostosowania metod HPLC
Kolumny Chromservis HPLC odpowiadające metodom USP oraz zakres, w jakim można dostosować różne parametry testu chromatograficznego bez zasadniczej modyfikacji farmakopealnych procedur analitycznych, są wymienione w tej nocie technicznej . Zmiany inne niż wskazane wymagają ponownej walidacji postępowania.
Dozowanie próbki w chromatografii Flash
Próbki płynne lub stałe o małych lub dużych objętościach - ponieważ Twoje próbki są różnorodne, oferujemy kilka opcji dozowania na kolumnę, aby zagwarantować najlepsze możliwe wyniki.
„Suchy ładunek”
Dostępne są jednorazowe plastikowe wersje głośników „Dry Load” lub głośniki w wersji ze stali nierdzewnej. Nadają się one do wielokrotnego użytku, a ich zaletą jest także większa odporność na wyższe ciśnienie.
Za pomocą kolumny ze stali nierdzewnej „Dry Load” można natryskiwać ciała stałe na kolumnę preparatywną lub na kolumny typu flash, gdzie maksymalny opór ciśnienia kolumny z tworzywa sztucznego byłby niewystarczający.
Pętle dozujące
Nasza linia pętli dozujących oferuje objętości od 100 μL do 50 mL, dzięki czemu możemy zaspokoić wszystkie Twoje potrzeby.
Autosampler
Zautomatyzuj dozowanie próbek za pomocą naszego automatycznego podajnika próbek i dziesięciokrotnie zwiększ wydajność. PuriFlash ® AS-1 umożliwia dozowanie próbek od 50 µL do 500 mL z automatycznym czyszczeniem zużytych probówek pomiędzy każdym wstrzyknięciem.
Dozowanie próbki zapewnia sekwencja oprogramowania InterSoft . Autosampler może być wyposażony w 6- lub 10-drogowy zawór elektryczny.
Platforma autosamplera posiada możliwość wykorzystania stojaka na probówki lub butelki o pojemności do 250 mL lub wykorzystania stojaków niestandardowych.
Pompa dozująca
Jeśli masz duże objętości próbek, które musisz umieścić na kolumnie flash lub preparatywnej, po prostu użyj naszej pompy, a następnie uruchom metodę. To jest takie proste!
Faza stacjonarna do HPLC
ASTRA - CHROMSERVIS
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m2/g) | % węgla | Zakres pH |
|---|---|---|---|---|---|
| C18-HE | 2, 3, 5, 10 | 100 | 330 | 17 | 2-9 |
| C18-AQ | 2. 3, 5 | 100 | 330 | 13 | 2-9 |
| C18-BDS | 3, 5 | 140 | 170 | 11 | 2-8 |
| C8-HE | 5 | 100 | 330 | 11 | 2-9 |
| C8-BDS | 3, 5 | 140 | 170 | 6 | 2-8 |
| Phenyl-Hexyl-HE | 3, 5 | 100 | 330 | 11 | 2-7.5 |
| DM | 3, 5 | 100 | 205 | 12 | 2-9 |
| Diol | 3, 5 | 100 | 330 | 5 | 2-7.5 |
ARION - CHROMSERVIS
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m2/g) | % węgla | Zakres pH |
|---|---|---|---|---|---|
| Oraz C18 | 1,7, 2,2, 3, 5, 10, 15 | 100 | 420 | 18 | 1,5-10 |
| Polarny C18 | 2.2, 3, 5, 10, 15 | 120 | 325 | 16 | 1,5-7,0 |
| C8 | 3, 5 | 120 | 325 | 11 | 2,0-7,0 |
| Fenylobutyl | 2.2, 3, 5 | 100 | 300 | 12 | 1,5-7,5 |
| NH2 | 2.2, 3, 5 | 120 | 325 | 5 | 2,0-6,5 |
| CN | 3, 5, 10 | 120 | 325 | 8 | 2,0-7,0 |
| HILIC Plus | 2.2, 3, 5 | 120 | 420 | - | 1,5-7,0 |
| Si | 2.2, 3, 5, 10 | 100 | 420 | - | 1,5-7,0 |
| SAX | 5 | 120 | 325 | - | 1.0-7.5 |
| SCX | 5 | 120 | 325 | - | 1.0-7.5 |
Na naszej stronie znajdziesz również instrukcję jak dbać o kolumny (U)HPLC Arion.
CHROMSHELL - CHROMSERVIS
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Efektywna powierzchnia (m 2 /g) | % węgla | Zakres pH |
|---|---|---|---|---|---|
| CHROMSHELL® C18 Plus | 2.6 | 85 | 130 | 9 | 1,5-7,5 |
| CHROMSHELL® C18-XB | 2.6 | 85 | 130 | 8 | 1,5-8,0 |
| CHROMSHELL® C18 Polar | 2.6 | 85 | 130 | 6.5 | 1,5-7,0 |
KINETEX – FENOMENKS
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Efektywna powierzchnia (m 2 /g) | % węgla | Zakres pH |
|---|---|---|---|---|---|
| Kinetex XB-C18 | 5, 2.6 | 100 | 200 | 10 | 1,5-8,5* |
| Kinetex C18 | 5, 2.6 | 100 | 200 | 12 | 1,5-8,5* |
| Kinetex C8 | 2.6 | 100 | 200 | 8 | 1,5-8,5* |
| Kinetex PFP | 5, 2.6 | 100 | 200 | 9 | 1,5-8,5* |
| Kinetex HILIC | 2.6 | 100 | 200 | 0 | 2,0-7,5 |
| Kinetex Fenylo-Heksyl | 5, 2.6 | 100 | 200 | 11 | 1,5-8,5* |
*Kolumny mają stabilność w zakresie pH 1,5 do 10 w warunkach izokratycznych. W elucjach gradientowych ich stabilność mieści się w zakresie pH 1,5 do 8,5.
Kolumny Kinetex 2,6 µm o średnicy wewnętrznej 2,1 mm są stabilne do ciśnienia 1000 barów, w pozostałych przypadkach do 600 barów.
Wypróbuj kolumny ChromShell, którymi możesz zastąpić kolumny Kinetex.
LUNA – FENOMENKS
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m 2 /g) | % węgla | Zakres pH | Kod USP |
|---|---|---|---|---|---|---|
| Luna Fenylo-heksyl | 3,5,10,15 | 100 | 400 | 17,5 | 1,5-10,0 | L11 |
| Luna Krzemionka (2) | 3,5,10,15 | 100 | 400 | - | - | L3 |
| Luna C5 | 5.10 | 100 | 440 | 12,5 | 1,5-10,0 | - |
| Luna C8 | 5.10 | 100 | 440 | 14.75 | 1,5-10,0 | L7 |
| Luna C8 (2) | 3,5,10,15 | 100 | 400 | 13,5 | 1,5-10,0 | L7 |
| Księżyc C18 | 5.10 | 100 | 440 | 19 | 1,5-10,0 | L1 |
| Luna C18 (2) | 2.5,3,5,10,15 | 100 | 400 | 17,5 | 1,5-10,0 | L1 |
| Luna CN | 3,5,10 | 100 | 400 | 7,0 | 1,5-10,0 | L10 |
| Luna NH 2 | 3,5,10 | 100 | 400 | 9,5 | 1,5-11,0 | L8 |
| Luna SCX | 5.10 | 100 | 400 | 0,55% zawartości siarki | 2,0-7,0 | L9 |
| Luna HILIC | 3.5 | 200 | 200 | - | 1,5-8,0 | - |
| Luna PFP(2) | 3 5 | 100 | 400 | 5.7 | 1,5-8,0 | L43 |
Bliźnięta - Fenomen
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m 2 /g) | % węgla | Zakres pH | Kod USP |
|---|---|---|---|---|---|---|
| Bliźnięta C18 | 3,5,10 | 110 | 375 | 14 | 1,0-12,0 | L1 |
| Bliźnięta C6-fenyl | 3.5 | 110 | 375 | 12 | 1,0-12,0 | L11 |
| Bliźnięta NX | 3,5,10 | 110 | 375 | 14 | 1,0-12,0 | L1 |
SYNERGIA – FENOMENKS
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m 2 /g) | % węgla | Zakres pH | Kod USP |
|---|---|---|---|---|---|---|
| Synergi Max-RP | 2.5 | 100 | 400 | 17 | 1,5-10,0 | - |
| Synergi Hydro-RP | 2.5 | 100 | 400 | 19 | 1,5-7,5 | L1 |
| Synergi Polar-RP | 2.5 | 100 | 440 | 11 | 1,5-7,0 | L11 |
| Synergi Fusion-RP | 2.5 | 100 | 440 | 12 | 1,5-10,0 | L1 |
| Synergi Max-RP | 4.10 | 80 | 475 | 17 | 1,5-10,0 | - |
| Synergi Hydro-RP | 4.10 | 80 | 475 | 19 | 1,5-7,5 | L1 |
| Synergi Polar-RP | 4.10 | 80 | 475 | 11 | 1,5-7,0 | L11 |
| Synergi Fusion-RP | 4.10 | 80 | 475 | 12 | 1,5-10,0 | L1 |
ONYKS – FENOMENKS
| Typ fazy | Rozmiar makroporów (µm) | Rozmiar porów (Å) | Powierzchnia (m 2 /g) | % węgla | Zakres pH | Kod USP |
|---|---|---|---|---|---|---|
| Onyks krzemionkowy | 2 | 130 | 300 | 0 | 2,0-7,5 | - |
| Onyks C8 | 2 | 130 | 300 | 11 | 2,0-7,5 | - |
| Onyks C18 | 2 | 130 | 300 | 18 | 2,0-7,5 | - |
Jowisz – zjawisko
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m 2 /g) | % węgla | Zakres pH | Kod USP |
|---|---|---|---|---|---|---|
| Jowisz C4 | 5, 10, 15 | 300 | 170 | 5,0 | 1,5-10,0 | L26 |
| Jowisz C5 | 5, 10, 15 | 300 | 170 | 5.5 | 1,5-10,0 | - |
| Jowisz C18 | 5, 10, 15 | 300 | 170 | 13.3 | 1,5-10,0 | L1 |
| Jowisz Proteo C12 | 4.10 | 90 | 475 | 15,0 | 1,5-10,0 | - |
GraceSmart – ŁASKA
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m 2 /g) | % węgla | Zakres pH | Kod USP |
|---|---|---|---|---|---|---|
| GraceSmart C18 | 3.5 | 120 | 220 | 10 | 2,0-9,0 | L1 |
Alltech ® Prevail - GRACE
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m 2 /g) | % węgla | Zakres pH | Kod USP |
|---|---|---|---|---|---|---|
| Przeważa C18 | 3.5 | 110 | 350 | 17 | L1 | |
| Przeważ C18 Wybierz | 3.5 | 110 | 350 | 15 | L1 | |
| Przewaga C8 | 3.5 | 110 | 350 | 8 | L7 | |
| Dominuj fenyl | 3.5 | 110 | 350 | 7 | L11 | |
| Przewaga cyjano (CN) | 3.5 | 110 | 350 | - | L10 | |
| Dominujący aminokwas (NH 2 ) | 3.5 | 110 | 350 | - | L8 | |
| Zdobądź krzemionkę | 3.5 | 110 | 350 | - | L3 | |
| Przeważają kwasy organiczne | 3.5 | 110 | 350 | - | - | |
| Węglowodany ES (polimer) | 5 | - | - | - | - |
Kolumny kapilarne / Nano LC ProteCol - SGE
| Typ fazy | Rozmiar cząstek (µm) | Rozmiar porów (Å) | Powierzchnia (m 2 /g) | % węgla | Zakres pH | Kod USP |
|---|---|---|---|---|---|---|
| ProteCol C18 | 3 | 120/300 | 350 | 17 | 2,0-7,5 | L1 |
| ProteCol C8 | 3 | 120/300 | 350 | 10 | 2,0-7,5 | L7 |
| ProteCol C4 | 3 | 120/300 | 350 | 2,0-7,5 | L26 | |
| ProteCol SCX | 3 | 120/300 | 350 | 2,0-7,5 | L9 |
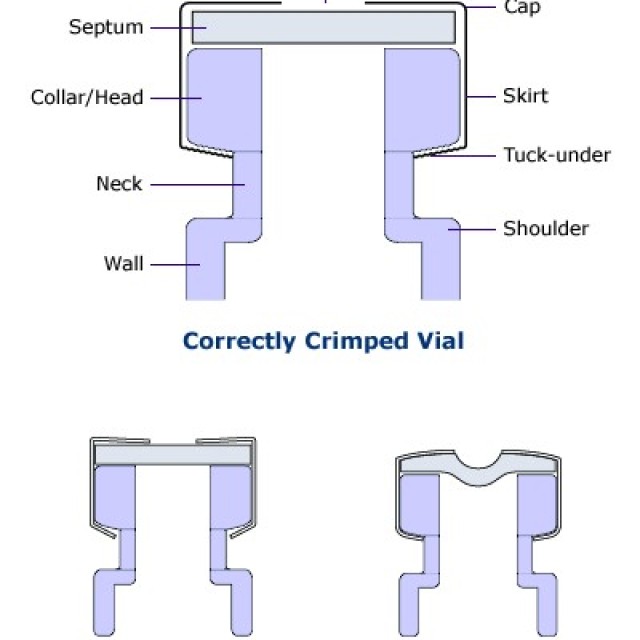
JAK PRAWIDŁOWO ZACISKAĆ FIOLKI
Fiolki zaciskane są doskonałymi pojemnikami na próbki do automatycznych dozowników chromatografów gazowych i cieczowych oraz do przechowywania próbek lub roztworów kalibracyjnych. Dla odpowiedniej szczelności bardzo ważna jest technika ich zamykania. W przypadku wycieku spowodowanego niewłaściwym uszczelnieniem może nastąpić odparowanie rozpuszczalnika lub utrata analitów.
Prawidłowo zamkniętą fiolkę można rozpoznać po tym, że jej wieczko po zamknięciu z trudem obraca się, a przegroda jest prosta.
Fiolkę zamykaną ze zbyt dużą siłą można rozpoznać po tym, że jej wieczko najczęściej nie daje się w ogóle odkręcić, a dodatkowo posiada wygiętą przegrodę (do wewnątrz). Jeżeli przegroda zostanie przekłuta igłą mikrostrzykawki, przegroda zostanie mocno obciążona, co spowoduje pogorszenie szczelności fiolki.
Fiolka, która nie posiada prawidłowo zamkniętej nakrętki ze względu na małą siłę szczypiec zaciskających, objawia się łatwym obracaniem nakrętki oraz, w niektórych przypadkach, rozwarciem materiału aluminiowego wokół dolnej krawędzi szyjki fiolki.
Można ustawić odpowiednią siłę szczypiec zamykających.
W starszych typach szczypiec siłę reguluje się obracając klucz imbusowy wewnątrz szczęk. Szczypce posiadają również śrubę oporową, która służy do ustawienia bezpiecznej odległości, aby nie używać zbyt dużej siły i tym samym uniknąć wycieku, a nawet mechanicznego uszkodzenia fiolki.
Dane chromatogramu masowego
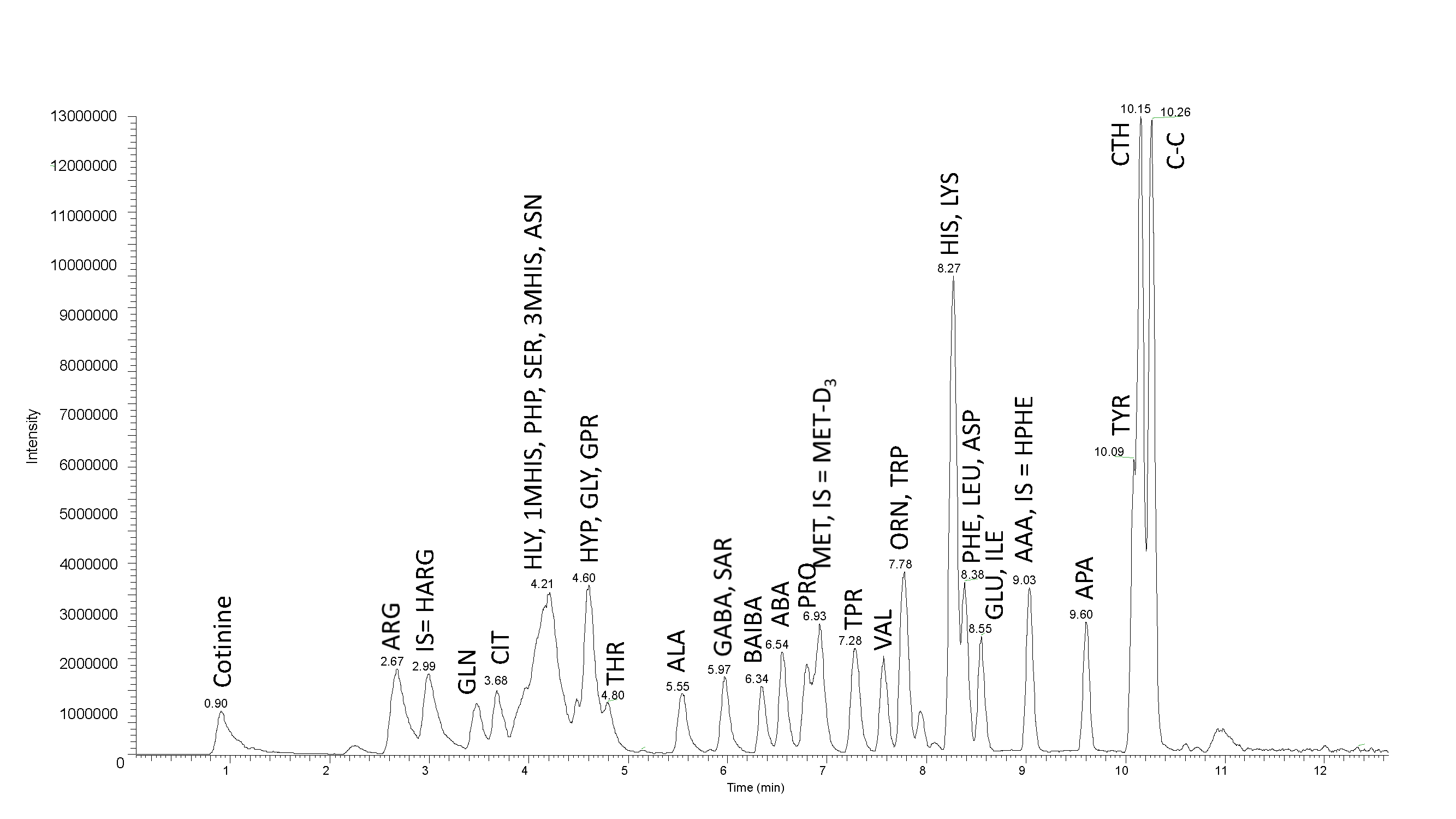
Ogromny. 1: Chromatogram masowy wzorców wewnętrznych, SD1 i SD2. Oddzielenie 5 nmol aminokwasów metodą LC-MS Metamino®
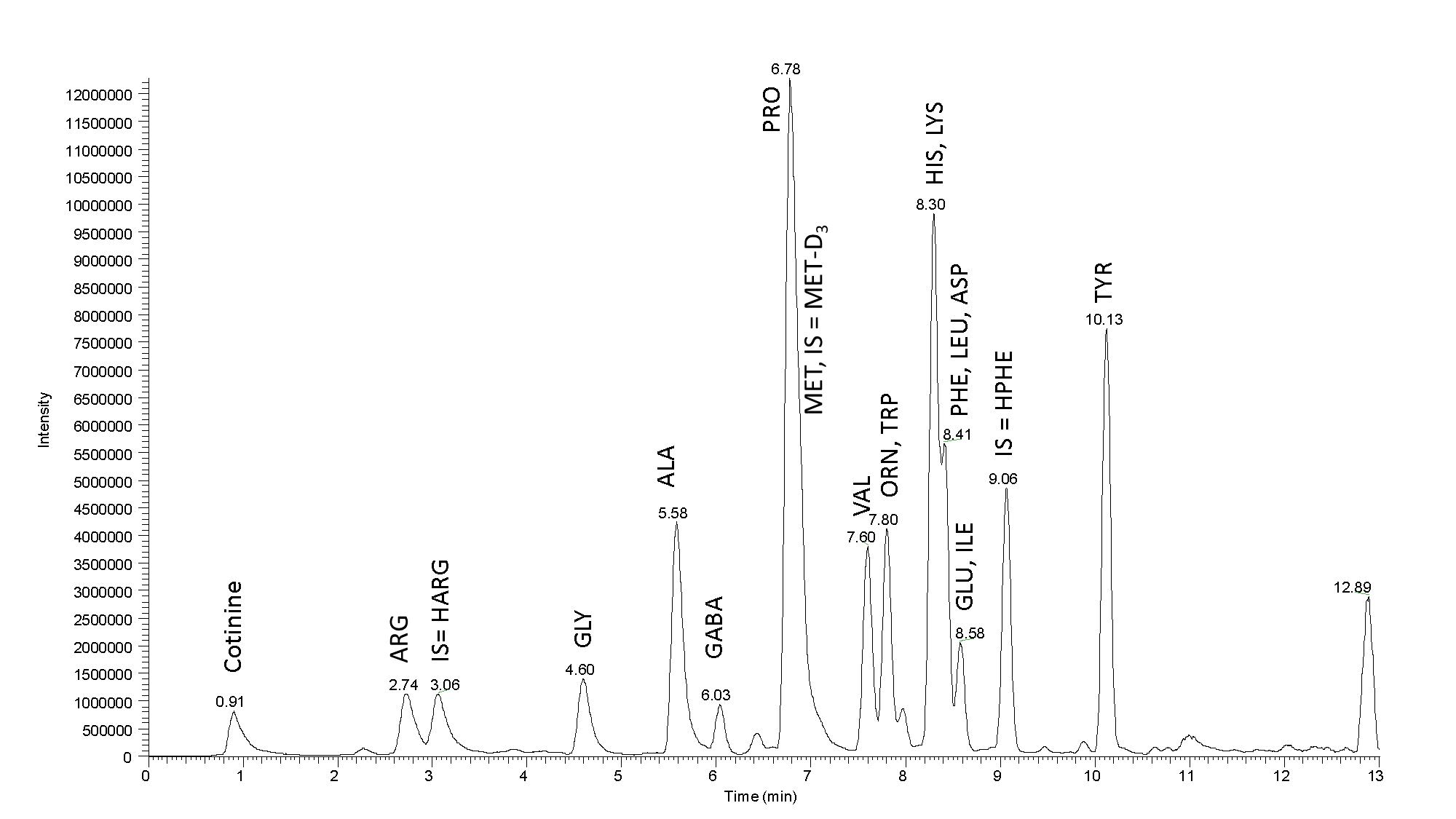
Ogromny. Ryc. 2: Chromatogram masowy próbki rzeczywistej: Rozdział aminokwasów w formule piwa Budvar 12˚ (na kolumnę naniesiono 25 µl próbki). Wysoka wydajność i wysoka rozdzielczość naszej kolumny przyczyniają się do dobrej separacji pików. Próbka testowana metodą LC-MS Metamino®
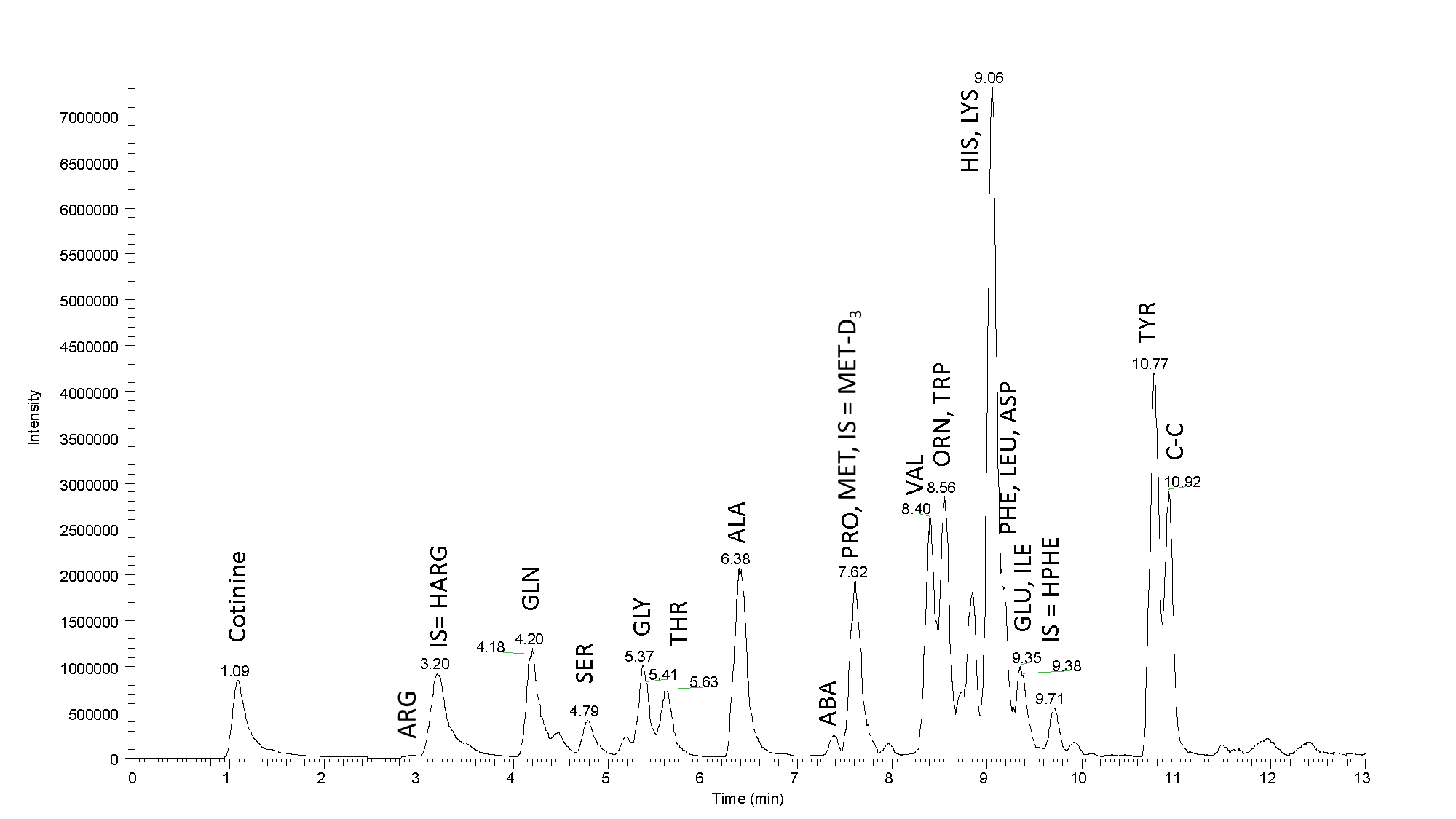
Ogromny. Ryc. 3: Chromatogram masowy próbki rzeczywistej: Rozdział aminokwasów obecnych w surowicy krwi (na kolumnę nałożono 25 µl wytrąconej surowicy). Wysoka wydajność i wysoka rozdzielczość naszej kolumny przyczyniają się do dobrej separacji pików. Próbka testowana metodą LC-MS Metamino®
przygotowanie próbki
Po wyodrębnieniu zawartości z matrycy można przystąpić do przygotowania próbki do analizy LC-MS/GC-MS.
Protokół ten jedynie w skrócie opisuje procedurę przygotowania próbki. Szczegółową procedurę można znaleźć w instrukcji obsługi Metamino®.
Analiza LC-MS przebiega w następujący sposób:
- Odpipetuj 100 μl wyekstrahowanej zawartości (surowicy, osocza, ...) i dodaj 100 μl podłoża wytrącającego. Wiruj przez 30 do 60 sekund przy 1500 g (6000 obr/min).
- Odpipetuj 25 µl wytrąconej próbki i dodaj 10 µl roztworu wzorca wewnętrznego do każdej fiolki do przygotowania próbki.
- Odpipetuj 25 μl roztworu katalizatora do każdej fiolki do przygotowania próbki i wiruj przez 5-10 sekund.
- Odpipetuj 10 μl roztworu odczynnika do każdej fiolki do przygotowania próbki i wiruj przez 5-10 sekund. Pozwól, aby derywatyzacja przebiegała przez co najmniej 2-3 minuty.
- Aktywuj i zrównoważ sorbent w filtrze mikrowirowym dodając:
- 200 µl podłoża aktywacyjnego MSPE, następnie wirować przez 30 do 60 sekund przy 1500 g (6000 obr/min).
- 200 µl podłoża do równoważenia sorbentu MSPE, następnie wirować przez 30 do 60 sekund przy 1500 g (6000 obr/min).
- Wylać płyn przez membranę.
- Rozcieńczyć mieszaninę reakcyjną derywatyzacji 400 µl środka do rozcieńczania i przemywania i wirować przez 5-10 sek.
- Nałożyć rozcieńczoną mieszaninę reakcyjną (zwykle 450-500 µl) na zwilżony sorbent z filtrem mikrowirowym i odstawić na 1-2 minuty. Wiruj przez 30 do 60 sekund przy 1500 g (6000 obr/min).
- Wylać płyn przez membranę.
- Przemyć sorbent w filtrze mikrowirówkowym 200 µl rozcieńczenia i medium płuczącego, a następnie wirować przez 30 do 60 sekund przy 1500 g (6000 obr/min).
- Umieścić filtr mikrowirówkowy w nowej fiolce wirówkowej, dodać 200 µl medium elucyjnego i wirować przez 30 do 60 sekund przy 1500 g (6000 obr/min).
- Przenieść eluat do fiolki autosamplera. Próbka jest gotowa do analizy LC-MS.
Analiza GC-MS przebiega w następujący sposób:
- Odpipetować 25 µl próbki docelowej i 10 µl roztworu wzorca wewnętrznego do każdej szklanej probówki reakcyjnej.
- Odpipetować 20 µl środka redukującego do każdej szklanej probówki reakcyjnej i krótko wstrząsać przez 5 do 10 sekund. Odstaw na 1 do 2 minut.
- Odpipetować 25 µl podłoża podstawowego do każdej szklanej probówki reakcyjnej i dodać 50 µl roztworu odczynnika (derywatyzacji) do każdej szklanej probówki reakcyjnej i wirować przez 5 do 10 sekund.
- Odpipetować 25 µl roztworu katalizatora do każdej fiolki do przygotowania próbki i wirować przez 5 do 10 sekund.
- Odpipetować 25 µl roztworu katalizatora do każdej fiolki do przygotowania próbki i wirować przez 5 do 10 sekund. Odstaw na 1-2 minuty. Emulsję stopniowo dzieli się na dwie warstwy.
- Odpipetuj 50 μl ośrodka ekstrakcyjnego do każdej fiolki do przygotowania próbki i wiruj przez 5 do 10 sekund.
- Odpipetuj 25 μl kwaśnego podłoża do każdej fiolki do przygotowania próbki i wiruj przez 5 do 10 sekund. Następnie wiruj przez 30 do 60 sekund przy 1500 g (6000 obr/min).
- Przenieść warstwę organiczną (górną) (50-100 µl) do fiolki autosamplera z wkładką. Próbkę przygotowuje się do analizy GC-MS.
Zawartość zestawu
Zestaw MetAmino ® zawiera wszystkie odczynniki, pożywki i chemikalia. Zawartość zestawu startowego przedstawiono w poniższych tabelach:
Zawartość zestawu LC-MS na 100 próbek:
| Przedmiot | Rodzaj fiolki | Objętość w fiolce (ml) | Liczba fiolek (100 próbek) |
| Roztwór wzorców aminokwasów SD1 | Fiolka 2 ml | 0,25 | 1 |
| Wzorce aminokwasów SD2 w postaci proszku | Fiolka 2 ml | - | 2 |
| Rozwiązanie z wewnętrznymi standardami (IS) | Fiolka 2 ml | 1.1 | 1 |
| Standardowe rozcieńczenie aminokwasów (AASDM) | Fiolka 4 ml | 1.4 | 1 |
| Medium aktywujące sorbent MSPE (WES) | Fiolka 40 ml | 22 | 1 |
| Medium równoważące sorbent MSPE (EQS) | Fiolka 40 ml | 22 | 1 |
| Roztwór katalityczny (CTS) | Fiolka 4 ml | 2.2 | 1 |
| Odczynnik (derywatyzacja) (RDS) | Fiolka 4 ml | 1.1 | 1 |
| Medium do rozcieńczania i przemywania (DWM) | Fiolka 40 ml | 33 | 2 |
| Medium elucyjne (ELM) | Fiolka 40 ml | 22 | 1 |
| Medium wytrącające (PM) | Fiolka 40 ml | 11 | 1 |
| Przedmiot | Ilość (100 próbek) | Notatka |
| Kolumna MetAmino® HPLC | 1 kawałek | Specjalna faza stacjonarna |
| Stojak na maksymalnie 80 probówek wirówkowych | 1 kawałek | |
| Filtry Microspin z sorbentem MetAmino ® | 100 szt | Kolumna wewnętrzna Membrana o grubości 0,22 µm |
| Probówki wirówkowe (2 ml) | 400 szt | |
| Fiolki do automatycznego podajnika próbek (zakrętka 9 mm) | 100 szt | Łącznie z przegrodą i pokrywkami |
Zawartość zestawu GC-MS na 100 próbek:
| Przedmiot | Rodzaj fiolki | Objętość w fiolce (ml) | Liczba fiolek (100 próbek) |
| Standardy aminokwasów SD1 (roztwór) | Fiolka 2 ml | 0,25 | 1 |
| Wzorce aminokwasów SD2 w postaci proszku | Fiolka 2 ml | - | 2 |
| Rozwiązanie z wewnętrznymi standardami (IS) | Fiolka 2 ml | 1.1 | 1 |
| Standardowe rozcieńczenie aminokwasów (AASDM) | Fiolka 4 ml | 1.4 | 1 |
| Środek redukujący (RA) | Fiolka 4 ml | 2,75 | 1 |
| Rozwiązanie podstawowe (BM) | Fiolka 4 ml | 2,75 | 1 |
| Roztwór katalityczny (CTS) | Fiolka 40 ml | 5.5 | 1 |
| Odczynnik (derywatyzacja) (RDS) | Fiolka 40 ml | 5.5 | 1 |
| Medium ekstrakcyjne (EM) | Fiolka 40 ml | 5.5 | 1 |
| Medium kwaśne (AM) | Fiolka 4 ml | 2,75 | 1 |
| Przedmiot | Kwota | Notatka |
| Kolumna MetAmino® GC | 1 kawałek | Specjalna faza stacjonarna |
| Szklane probówki reakcyjne | 100 szt | - |
| Stojak na maksymalnie 80 probówek reakcyjnych | ||
| Fiolki do automatycznego podajnika próbek (zakrętka 9 mm) | 100 szt | Łącznie z przegrodą i pokrywkami |
| Wkładki do fiolek autosamplera | 100 szt | - |
Opis
Nasze zestawy MetAmino ® LC-MS i GC-MS zapewniają szybką, niezawodną, powtarzalną i dokładną procedurę analizy aminokwasów, która obejmuje zarówno przygotowanie próbki, jak i rozdział chromatograficzny.
Metoda LC-MS opiera się na mikroekstrakcji do fazy stałej przy użyciu specjalnych filtrów mikrospinowych ( MSPE ) z nowo opracowanym sorbentem i zintegrowaną membraną 0,22 µm, metoda GC-MS wykorzystuje mikroekstrakcję ciecz-ciecz ( LLME ) do przygotowania. Po tej wstępnej obróbce próbkę analizuje się w LC-MS (GC-MS). W sumie przygotowanie próbki do LC-MS zajmuje około 8 minut, a analiza próbki 12 minut, więc cały czas trwania eksperymentu wynosi tylko 20 minut. Całkowity czas eksperymentu GC-MS jest jeszcze krótszy – około 17 minut.
Ten unikalny zestaw spełnia wszystkie wymagania laboratoryjne i jest przeznaczony dla wszystkich użytkowników końcowych poszukujących prostej metody analitycznej i wysokiej wydajności separacji.
Przegląd sorbentów MSPE
Sorbenty do techniki MSPE dobierane są tak, aby obejmowały jak najszerszy zakres zastosowań. MSPE SpeExtra C18 to hydrofobowy rodzaj oktadecylowego żelu krzemionkowego ze specjalną końcówką o bardzo szerokim zastosowaniu. Nadaje się do szerokiego zakresu analitów, wykazując gorszą retencję dla związków polarnych. MSPE SpeExtra C18-P to modyfikowany polarnie monomeryczny oktadecylowy żel krzemionkowy. Oferuje różne rodzaje oddziaływań: dipol-dipol, π-π i hydrofobowe. Dlatego nadaje się do związków aromatycznych i polarnych. Sorbent polimerowy MSPE SpeExtra HLB o dużej powierzchni właściwej i specjalnej osłonie końcowej. Posiada hydrofilową i lipofilową modyfikację zapewniającą uniwersalne zastosowanie i większą pojemność niż żel krzemionkowy C18. MSPE SpeExtra WAX to sorbent polimerowy na bazie PS/DVB ze specjalnym zakończeniem i wysoce specyficzną powierzchnią, który powstaje w wyniku kopolimeryzacji styrenu i diwinylobenzenu, tworząc słabe oddziaływania anionowe.
| Sorbent MSPE | Wielkość cząstek [µm] | Powierzchnia właściwa [m 2 /g] |
| C18 | 60 | 310 |
| C18-P | 60 | 310 |
| HLB | 30 | 850 |
| WAX | 30 | 850 |
Oczyszczanie i testowanie na konopie
 Konopie zawierają setki kannabinoidów, przy czym kannabidiol (CBD) występuje w największej ilości w roślinie, a Δ 9-tetrahydrokannabinol (THC) jest aktywnym składnikiem wywołującym efekty psychotropowe. Istnieje jednak wiele innych związków, które są wytwarzane przez konopie indyjskie i zostały zbadane pod kątem ich działania leczniczego. Ograniczenie to często wymaga obróbki destylowanego ekstraktu z konopi (usunięcie THC z ekstraktu wyjściowego) i można je osiągnąć za pomocą chromatografii preparatywnej, takiej jak system puriFlashR XL-Cannabis. Analizę HPLC materiału wyjściowego (destylatu), frakcji zebranych podczas procesu oczyszczania oraz produktu końcowego można przeprowadzić za pomocą systemu analitycznego Advion AVANT HPLC-UV. Zarówno metody oczyszczania, jak i analityczne są przedstawione w tej piwonii i stanowią kompletne rozwiązanie do usuwania THC w przemyśle konopnym.
Konopie zawierają setki kannabinoidów, przy czym kannabidiol (CBD) występuje w największej ilości w roślinie, a Δ 9-tetrahydrokannabinol (THC) jest aktywnym składnikiem wywołującym efekty psychotropowe. Istnieje jednak wiele innych związków, które są wytwarzane przez konopie indyjskie i zostały zbadane pod kątem ich działania leczniczego. Ograniczenie to często wymaga obróbki destylowanego ekstraktu z konopi (usunięcie THC z ekstraktu wyjściowego) i można je osiągnąć za pomocą chromatografii preparatywnej, takiej jak system puriFlashR XL-Cannabis. Analizę HPLC materiału wyjściowego (destylatu), frakcji zebranych podczas procesu oczyszczania oraz produktu końcowego można przeprowadzić za pomocą systemu analitycznego Advion AVANT HPLC-UV. Zarówno metody oczyszczania, jak i analityczne są przedstawione w tej piwonii i stanowią kompletne rozwiązanie do usuwania THC w przemyśle konopnym.
- Urządzenie puriFlah ® L-Cannabis o wydajności do 4,3 kg/dzień (kolumny do 15 cm ID)
- Narzędzie do konopi puriFlah ® XL o wydajności do 12,2 kg/dzień (kolumny do 20 cm ID)
- Czytnik płytek Plate Express TLC
- Pokaż wszystko

Carbon disulphide - detection tubes 0.63-100ppm, package 5+5 pcs
Dostępność: na zapytanieNa życzenie
Single channel pipette with adj. volume Transferpette S 1-10 ml
Dostępność: na zapytanieNa życzenie
SS Mass Flow Controler, model GFC67S (max.flowrate 500l/min air)
Dostępność: na zapytanieNa życzenie



Aluminium Mass Flow Controler, model GFC17A (max.flowrate 10l/min air)
Dostępność: na zapytanieNa życzenie